|
Осложнения микрохирургической фаллопластики у транссексуалов. Акад. Рамн Н.О. МИЛАНОВ, д-р мед. наук Р. Т. АДАМЯН, Т. В. КАЗАРЯН Российский научный центр хирургии РАМН, Москва |
Complications of microsurgical phalloplasty in transsexuals. N.O. MILANOV, member of the Russian Academy of Medical Sciences, R.T. ADAMYAN, doctor of medical sciences, T.V. KAZARYAN Russian Research Centre of Surgery, Russian Academy of Medical Sciences, Moscow |
||||||||||||||||||||||||||||||||||||||||
ВведениеОдин из основных этапов хирургической смены анатомически женского пола на мужской при ядерных формах транссексуализма — фаллопластика, которая является сложной задачей пластической и реконструктивной хирургии [1]. На сегодня предложено много вариантов фаллопластики, которые основаны на различных методах местной или дистантной пластики [1 — 10]. Наибольший интерес в последние годы привлекает метод фаллопластики, который основан на свободной микрохирургической аутотрансплантации реваскуляризированных тканей, что стало возможным благодаря развитию и широкому внедрению микрохирургии [1–2]. Среди свободных микрохирургических аутотрансплантатов заслуживает внимания лоскут из области широчайшей мышцы спины (торакодорсальный лоскут). В состав питающей ножки лоскута кроме артерии и вены входит двигательный торакодорсальный нерв, который используют для восстановления двигательной иннервации мышечной основы лоскута [2]. Торакодорсальный лоскут весьма широко распространен в клинической микрохирургии благодаря своим уникальным пластическим возможностям, которые позволили нам формировать необходимого размера неофаллос с хорошими эстетическими и функциональными показателямии с минимальным количеством осложнений [1,11, 12]. Материалы и методыС 1991 по 2000 гг. в отделе восстановительной микрохирургии РНЦХ РАМН микрохирургическая фаллопластика с использованием торакодорсального лоскута при смене анатомически женского пола на мужской выполнена у 114 транссексуалов. При этом использовано 116 аутотрансплантатов из области широчайшей мышцы спины. Возраст оперированных пациентов - 19–46 лет. Все пациенты находились на этапах хирургической смены пола. У 106 пациентов была выполнена изолированная фаллопластика ( 108 свободных микрохирургических реваскуляризированных аутотрансплантатов из области широчайшей мышцы спины — торакодорсальный лоскут — I группа пациентов ) и у 8 пациентов — одномоментная фаллопластика и уретропластика ( 8 торакодорсальных лоскутов и 8 свободных микрохирургических реваскуляризированных аутотрансплантатов из области предплечья — лучевой лоскут — И группа пациентов). Наличие пациентов с одномоментной фаллоуретропластикой связано с периодом отработки методики и техники хирургического лечения транссексуалов. В настоящее время одномоментную фаллоуретропластику мы не используем, поскольку разрабатываем более эффективную тактику выполнения тотальной уретропластики. Ширина кожной части торакодорсального лоскута варьировала от 10 до 16 см и зависела от конституции пациента и развитости широчайшей мышцы спины. Длина лоскута составила 16–22 см. Ориентиром выбора размера лоскута служило желание пациента, при этом учитывали его конституциональные особенности. Срок аноксии лоскутов колебался от 2 ч 25 мин до 5 ч 10 мин. Среднее время аноксии 3 ч 30 мин. Столь большой срок аноксии лоскутов, к сожалению, зависит от методики операции, так как сам лоскут берется в традиционном положении пациента на боку, а работа в реципиентной области возможна только при положении пациента на спине. Сам забор торакодорсального лоскута длится 40–45 мин. Таким образом, большую часть времени аноксии занимает период ушивания донорского дефекта, что представляет отдельную проблему. Результаты и обсуждениеВ результате микрохирургической фаллопластики с использованием торакодорсального лоскута в период 1991–2000 гг. у 20 пациентов были отмечены 36 послеоперационных осложнений. В 31 (86,1%) наблюдении осложнения отмечены в ближайшем послеоперационном периоде. В 5 (13,9%) наблюдениях осложнения развились в отдаленном послеоперационном периоде, а причиной их послужили осложнения, развившиеся в ближайшем послеоперационном периоде, которые представлены в табл. 1. |
IntroductionPhalloplasty is a key procedure of the surgical female-to-male anatomical sex conversion in subjects with nuclear transsexualism. It still constitutes a serious challenge to many plastic and reconstructive surgeons [1]. Numerous variants of phalloplasty currently available for the purpose are all based on the use of tissue flaps harvested in the body regions located close to or far from the recipient zone [1–10]. Of late, there has been an increasingly growing interest in a phalloplastic technique which consists of the microsurgical autotransplantation of free revascularized tissues. This approach has become possible due to the considerable progress in the development of microsurgical procedures and their wide application in clinical practice [1–2]. A thoracodorsal flap cut from the broadest muscle of the back appears to be the most promising material among free microsurgical autografts employed in phalloplasty. Its feeding pedicle contains the motor thoracodorsal nerve (apart from an artery and a vein) which is indispensable for the reinnervation of the muscular portion of the flap and thus the restoration of its motor function [2]. Thoracodorsal flaps are widely adopted in clinical microsurgery by virtue of their unique plastic properties allowing for the construction of a naturally-looking and functionally competent neophallus of the desired length with a minimal risk of postoperative complications [1,11,12]. Materials and methodsMicrosurgical phalloplasty with thoracodorsal flaps for the female-to-male anatomical sex conversion was performed in 114 transsexual subjects admitted to the Department of Reconstructive Microsurgery, Russian Research Centre of Surgery, between 1991 and 2000. A total of 116 musculus latissimus dorsi autografts were used forthe purpose. All patients aged from 19 to 46 years needed a different volume of surgical intervention for sex conversion. One hundred and six patients that comprised group I of our series underwent isolated phalloplasty with a thoracodorsal flap (a total of 108 free microsurgical revascularized autografts were cut from the broadest muscle of the back). The remaining 8 patients underwent one-step combined phallourethroplasty using 8 thoracodorsal and 8 free microsurgical revascularized radial forearm autografts — group II. Simultaneous phallo- and urethroplasty was practised in the early period of work with transsexuals by which time we had not yet acquired a broad experience with microsurgical sex correction. To-day, we no longer employ one-step phallourethro-plasty using instead a more efficient technique of total urethroplasty, the development of which is underway. The cutaneous portion of thoracodorsal flaps was 10–16 cm wide depending on the patient's constitution and the size of the latissimus dorsi muscle. The length of the flaps varied from 16 to 22 cm and was chosen in accordance with the patient's will and individual constitutional features. The flaps remained anoxic for 2 hr 25 min up to 5 hr 10 min (mean 3 hr 30 min). Unfortunately, the length of anoxia could not be reduced for technical reasons (a flap had to be cut out from the patient in side position while surgical manipulations in the recipient region were possible to perform only in supine position). It normally took 40–45 min to harvest a flap. Suturing the donor wound presented a separate surgical problem and was the most time-consuming stage of the harvesting procedure responsible for the considerable length of anoxia. Results and discussionMicrosurgical phalloplasty using thoracodorsal flaps which was performed between 1991 and 2000 produced 36 postoperative complications in 20 patients. Thirty one (86.1 %) complications developed in the immediate and the remaining 5 (13.9%) in the late postoperative period. The majority of late complications originated from the early ones which are listed in table 1. All late complications can be reduced to cicatrical deformities of the neophallus. They occurred in 4 patients following phalloplasty and in one after simultaneous phallo-and urethroplasty. |
||||||||||||||||||||||||||||||||||||||||
|
Таблица 1. Распределение ближайших осложнений по видам / Table 1. Major types of early postoperative complications
|
|||||||||||||||||||||||||||||||||||||||||
|
Что касается отдаленных осложнений, то все они заключались в рубцовой деформации неофаллоса и у 4 пациентов развились после фаллопластики, а у 1 пациента — после одномоментной фаллоуретропластики. Тотальный некроз торакодорсального лоскута развился у 1 пациента. Ему была выполнена стандартная фаллопластика торакодорсальным лоскутом. Размеры кожной части лоскута составили 13,5×16 см. Время аноксии лоскута составило 3 ч 20 мин. Артериальный анастомоз — между торакодорсальной артерией и левой нижней эпигастральной артерией по типу «конец-в-конец» отдельными узловыми швами нитью 8/0 и венозный анастомоз — между торакодорсальной веной и одной из комитантных нижних эпигастральных вен по типу «конец-в-конец» непрерывным швом нитью 8/0. Через 12 час после операции был диагностирован острый артериальный тромбоз сосудистой ножки лоскута и пациент экстренно реоперирован. При ревизии анастомозов в области нижней эпигастральной артерии недалеко от ее устья и в 2 см от анастомоза обнаружена атеросклеротическая бляшка, которая и стала причиной острого продолженного артериального тромбоза. Пораженный участок нижней эпигастральной артерии вместе с анастомозом был иссечен и замещен участком реверсированной аутовены длиной 4 см. После снятия клипс кровообращение в лоскуте было восстановлено. Послеоперационный период протекал гладко, несмотря на то, что пациент постоянно не соблюдал постельный режим и много курил. На 16 сутки после первой операции наступил тотальный смешанный артериальный и венозный тромбоз лоскута, что явилось причиной его некроза. В последующем пациенту была выполнена фаллопластика контрлатеральным торакодорсальным лоскутом. Размеры кожной части лоскута 13,5×16 см. Аноксия лоскута составила 3 ч 15 мин. При ревизии правой нижней эпигастральной артерии признаков ее атеросклеротического поражения на всем протяжении не выявлено. Послеоперационный период протекал гладко. Полное приживление лоскута. Относительно большое количество осложнений было связано с неправильной выкройкой лоскута. После сворачивания лоскута в трубку в 22 наблюдениях мы отмечали ухудшение кровообращения, что было связано со сдавлением мышцы лоскута после наложения кожных швов. При этом 20 наблюдений относились к пациентам I группы и 2 наблюдения — к пациентам II группы. В результате в 17 наблюдениях развился очаговый поверхностный некроз кожи лоскута, в основном локализовавшийся по ходу послеоперационных швов и у основания неофаллоса. В 2-х наблюдениях отмечен сегментарный некроз концевого отдела неофаллоса. В 3-х наблюдениях в течение первых часов после операции после своевременной декомпрессии лоскута путем снятия ряда швов, наложенных по продольной оси неофаллоса, кровообращение компенсировалось, что позволило избежать образования очаговых некрозов кожи. Изолированные кожные некрозы ликвидировали дополнительным хирургическим вмешательством — так называемыми корригирующими операциями. Небольшие поверхностные некрозы размером до 1,5– 2 см после санации заживали вторичным натяжением, а более крупные очаги после хирургической обработки и появления грануляции укрывали аутокожей. Что касается 2-х наблюдений сегментарного концевого некроза неофаллоса, то нужно отметить, что после некрэктомии и санирования раны в 1 наблюдении произвели пластику неофаллоса промежностно-бедренными ротированными лоскутами, а в другом — пластику ротированным паховым лоскутом. Наблюдение 1. Пациент Р., 23 года, история болезни № 347825, вес 92 кг, рост 175 см, гиперстеник, поступил в клинику 07.10.96 г. с диагнозом: транссексуализм, ядерный тип, на этапное лечение. 14.10.96 г. произведена фаллопластика торакодорсальным лоскутом. Размеры кожной части лоскута составили 18×15 см. Ишемия лоскута составила 4 ч 30 мин. Пациент интраоперационно и в послеоперационном периоде получал профилактическую антибиотикотерапию, антиагреганты. Исключили курение в послеоперационном периоде. На 3-й сутки после фаллопластики произошел концевой некроз кожи и подкожной жировой клетчатки неофаллоса. Произведена некрэктомия в пределах здоровых тканей. Рана очистилась и 29.11.96 г. выполнено пластическое закрытие дефекта неофаллоса промежностно-бедренными ротированными лоскутами. Через 6 дн после операции сформировался очаг краевого кожного некроза ротированного лоскута. После санации и очищения раны 26.12.96 г. произведена пластика дефекта неофаллоса расщепленным кожным лоскутом. 10 01.97 г. в удовлетворительном состоянии пациент был выписан на амбулаторное лечение. |
Total necrosis of the thoracodorsal flap was recorded in one patient after standard phalloplasty. The cutaneous portion of the flap was 13.5×16 cm, anoxia lasted 3 hr 20 min. End-to-end arterial anastomosis between thoracodorsal artery and left inferior epigastric artery was constructed with a few 8/0 interrupted sutures. The thoracodorsal vein was anastomosed end-to-end with one of the comitant inferior epigastric veins using a 8/0 continuous suture. Acute arterial thrombosis of the vascular pedicle developed 12 hours after surgery which required urgent reoperation. Revision of the anastomoses revealed an atherosclerotic plaque close to the opening of the inferior epigastric artery and 2 cm from the anastomosis. The plaque was considered to be responsible for the protracted acute arterial thrombosis. The affected portion of the inferior epigastric artery was resected together with the anastomosis and substituted by a 4-cm long fragment of a reversed autovein. Blood circulation in the flap was restored after the removal of the clips. Thereafter, the postoperative period was uncomplicated despite the intensity of the patient's smoking habit and casual attitude toward compliance with the recommended bed-rest regime. On day 16 after the first surgery, the patient developed total mixed arteriovenous thrombosis of the transferred flap which resulted in necrosis. The second phal-loplasty was accomplished using a contralateral thoracodorsal flap, with the cutaneous portion measuring 13.5×16 cm. The period of anoxia between the harvesting and transplantation of the flap was as long as 3 hr 15 min. The revision of the right inferior epigastric artery revealed no signs of atherosclerotic degeneration along the entire length of the vessel. The postoperative period was uneventful, the transplanted flap remained perfectly viabile. A relatively large number of postoperative complications was due to a defective flap cutting procedure. In 22 patients, impaired circulation in the flap was documented after it was folded in a tube because of excessive pressure exerted by the apposition suture on its muscular portion. This complication occurred in 20 patients of group I and in two patients of group II. As a result, 17 patients suffered focal surface necrosis of the flap skin which largely developed along the postoperative sutures and at the base of the neophallus. Two patients exhibited segmental necrosis of the terminal parts of the neophalus. In 3 patients, the sutures placed along the longitudinal axis of the neophallus were removed within a few hours after surgery. The resulting relieve of excessive tension on the flap was conducive to an improved blood circulation and thus allowed the development of focal skin necrotization to be prevented. Isolated skin necroses were eradicated by additional surgical manipulations, the so-called corrective operations. Small surface necroses measuring 1.5–2 cm healed by second intention following sanation. Bigger necrotic foci were managed by the surgical treatment and subsequent closure of the resultant defect with the autoskin (after the onset of granulation). In two patients with segmental necrosis at the tip of the neophallus, the necrectomy and sanative treatment of the resulting wound were followed by the plastic correction of the neophallic defect using rotated perineofemoral flaps (1) or a rotated inguinal flap (1). Case report No. 1. Patient R., case record No. 347825, a 23year-old hyperstenic subject, weight 92 kg, height 175 cm. The patient was hospitalized in our clinic on 7 October, 1996 for the staged treatment. Diagnosis on admission: nuclear transsexualism. Phalloplasty with a thoracodorsal flap was undertaken on 14 October 1996. The cutaneous portion of the flap was 18×15 cm in size and the length of ischemia was 4 hr 30 min. Intra- and postoperatively, the patient received preventive antibacterial and anticoagulative therapy. Smoking in the postoperative period was not permitted. Three days after surgery, end skin and subcutaneous fat necrosis of the neophallus was noticed. Necroctic tissue was resected together with the surrounding normal one. The wound was found free from debris and closed with rotated perineofemoral flaps (29 November, 1996). Six days after this operation, the rotated flap showed focal edge necrosis of its skin component. Following sanative treatment and cleansing of the wound, the neophallic defect was closed with a split-thickness cutaneous graft (26 December, 1996). The patient was discharged in good clinical condition on 10 January, 1997 for the subsequent outpatient treatment. In the late postoperative period, the patient developed cicatrical deformity at the posterior surface of the neophallus which resulted in its bending. On 17 September, 1997, he underwent corrective surgery for plastic restoration of the normal shape of the neophallus and the formation of its head. After 7 days, the surface necrosis at the lower side of the neophallic head affected the area of 2.5×3 cm. In addition, the sutures at the neophallic base yielded over an area of 1.5×1.5 cm. On 2 October, 1997, the patient was discharged from the clinic for the ambulatory treatment of 1.5×1.5×1.5 cm dry surface necrosis at the lower side of the head of the neophallus. |
||||||||||||||||||||||||||||||||||||||||
 |
 |
||||||||||||||||||||||||||||||||||||||||
|
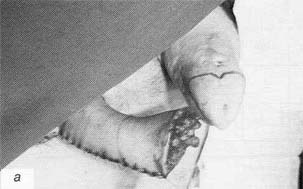
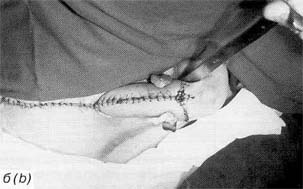
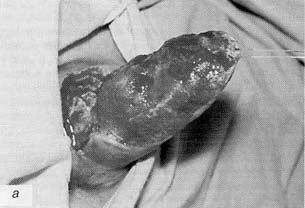
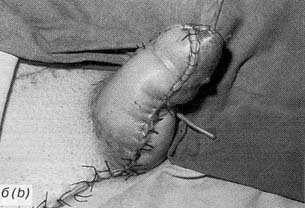
Рис. 1. Неофаллос после некрэктомиии (а); неофаллос после укрытия ротированным паховым лоскутом (б) Fig. 1. Neophallus following necrectomy (a); the same after covering the wound with a rotated inguinal flap (b) |
|||||||||||||||||||||||||||||||||||||||||
|
У пациента в отдаленном послеоперационном периоде развилась рубцовая деформация неофаллоса по задней поверхности, что привело к искривлению неофаллоса. 17.09.97 г. ему была выполнена корригирующая операция, заключающаяся в местной пластике и формировании головки неофаллоса. На 7-е сутки после операции сформировался поверхностный некроз по нижней поверхности головки неофаллоса на участке 2,5×3 см и разошлись швы у основания неофаллоса на участке 1,5×1,5 см. 02.10.97 г. пациент был выписан на амбулаторное лечение с поверхностным сухим некрозом нижней части головки неофаллоса размером 1,5×1,5×1,5 см. После отторжения участков кожного некроза и формирования рубцов пациенту в феврале 1999 г. выполнено повторное пластическое устранение рубцов местными тканями. Послеоперационный период протекал гладко. Заживление первичным натяжением. Наблюдение 2. Пациент В., история болезни № 167355, вес 64 кг, рост 164 см, нормостеник, поступил в клинику 22.10.92 г. с диагнозом: транссексуализм, ядерный тип, на этапное лечение. 26.10.92 г. произведена фаллопластика торакодорсальным лоскутом. Размер кожной части лоскута составил 13×16 см. Время ишемии торакодорсального лоскута — 3 ч 30 мин. На 4-е сутки после операции наступил частичный некроз по задней поверхности и дистальной части неофаллоса. После хирургической обработки некроза и очищения послеоперационной раны (рис. 1а) 07.12.92 г. выполнена пластика (укрытие) гранулирующей раны неофаллоса ротированным паховым лоскутом (рис. 16). Послеоперационный период протекал гладко, пациент выписан 22.12.92 г. в удовлетворительном состоянии. |
After the necrotized tissue was rejected and cicatrization completed, the patient underwent another surgical intervention for the plastic substitution of cicatrices by the surrounding tissues (February 1999). The postoperative period was uncomplicated, wound healing occurred by first intention. Case report No. 2. Patient V., case record No. 167355, normostenic, weight 64 kg, height 164cm. The patient was hospitalized in our clinic on 22 October 1992 for the staged treatment. Diagnosis on admission: nucleartranssexualism. Phalloplasty with a thoracodorsal flap was undertaken on 26 October, 1992. The cutaneous portion of the flap was 13×16 cm in size and the duration of ischemia was 3 hr 30 min. Four days after surgery, partial necrosis at the posterior and distal sides of the neophallus was noticed. Surgical treatment of the necrotic lesion and cleansing of the resulting wound (fig. 1a) were followed by its plastic correction on 7 December 1992 (closure with a rotated inguinal flap after the onset of granulation (fig. 1 b). On 22 December, 1992, the patient was discharged from the clinic in reasonably good conditions for further treatment in an outpatient setting. Two years after surgery, the patient developed cicatrical deformity of the neophallus which caused its contraction to 12 cm (fig. 2a). On 21 December 1994, the neophallus was lengthened with a 10×8 cm rotated inguinal flap (fig. 2fo). On 20 February 1995, the feeding pedicle of the inguinal flap was cut off. The postoperative period was uncomplicated. The patient's condition was satisfactory, and he was discharged with good aesthetic and cosmetic results of surgical treatment (fig. 2c). |
||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
Рис. 2 Удаление рубцово — деформированного неофаллоса ротированным паховым лоскутом а — этап формирования трубки из пахового лоскута; б — завершенный интраоперационный вид до отсечения пахового лоскута; в — окончательный вид неофаллоса после удлинения Fig. 2. Lengthening of the cicatrically deformed neophallus with a rotated inguinal flap a — folding the flap in a tube; b — final intraoperative view prior to the dissection of the inguinal flap; с — neophallus after the completion of the lengthening procedure |
||||||||||||||||||||||||||||||||||||||||
|
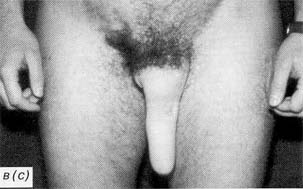
Через 2 года у пациента была отмечена рубцовая деформация неофаллоса и вследствие этого значительное укорочение последнего до 12 см (рис. 2а). 21.12.94 г. выполнено удлинение неофаллоса ротированным паховым лоскутом (рис. 26). Размер пахового лоскута составил 10×8 см. Послеоперационный период протекал гладко. 20.02.95 г питающая ножка пахового лоскута была отсечена. Послеоперационный период протекал гладко, и больной выписан в удовлетворительном состоянии с хорошим эстетическим и косметическим результатом (рис. 2в). В отдаленном послеоперационном периоде у пациента наблюдалась рубцовая деформация с последующим искривлением неофаллоса. 23.09.98 г. произведена корригирующая операция — местная кожная пластика с коррекцией положения неофаллоса с хорошим окончательным результатом. Исследования показали, что ширина широчайшей мышцы спины, включаемой в лоскут, должна быть меньше его кожной части не менее чем на 1,5–2 см по обоим краям лоскута. Если разницу в ширине кожной и мышечной частей увеличить за счет уменьшения ширины мышечной части лоскута, может возникнуть дефицит кровоснабжения в области кожных краев лоскута, который приведет к образованию локальных краевых некрозов. Если же разницу в ширине кожной и мышечной части уменьшить, увеличив мышечную часть лоскута, то последний будет либо крайне сложно свернуть в трубку, либо полученное избыточное натяжение кожных краев при сворачивании лоскута в трубку также приведет к некрозу кожных краев лоскута. Наша многолетняя практика показывает, что рекомендуемая ширина широчайшей мышцы спины должна быть не менее 6 см, при условии центрального расположения по отношению к кожной части лоскута. |
In the late postoperative period, the patient developed cicatrical deformity of the neophallus which resulted in its bending. On 23 September 1998, he underwent corrective surgery for the plastic restoration of the normal shape of the neophallus using the adjacent tissues. This operation afforded a good final result. Our studies have demonstrated that the cutaneous portion on either side of the latissimus dorsi fragment to be used as a flap for phalloplasty must be at least 1.5–2 cm wider than its muscular component. If the relative width of the cutaneous portion is greater than that due to the decreased width of the muscular tissue, the blood supply of the flap edges may be impaired. Hence, a risk of local edge necrosis. Conversely, if the cutaneous margins of the flap are narrower as a result of a greater width of its muscular portion, it will be difficult to fold the flap as a tube or the folding will result in excessive tension of the skin at flap edges. In the latter case, a local edge necrosis is equally likely to develop. Years of experience convinced us that the latissimus dorsi muscle of a flap must be at least 6 cm wide and localized full in the centre of its cutaneous coating. It has been mentioned in a previous paragraph that postoperative complications due to an improper flap harvesting procedure may lead to a cicatrical deformity of the neophallus in the late postoperative period. This, in turn, is fraught with the bending of the neophallus which may seriously deteriorate the patient's quality of life. Such a complication occurred in 5 of our patients. Cicatrical deformities were managed by corrective operations. |
||||||||||||||||||||||||||||||||||||||||
|
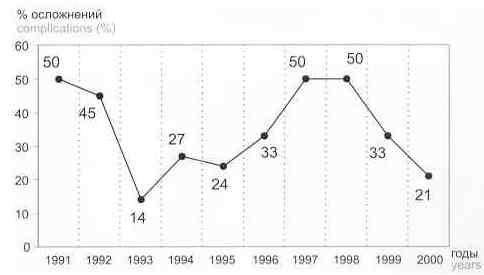
Таблица 2. Динамика осложнений фаллопластики Table 2. Dynamics of postoperative complications of phalloplasty
Рис. 3. Динамика осложнений фаллопластики у транссексуалов в зависимости от числа операций, выполненных за период 1991–2000 гг. Fig. 3. Dynamics of postoperative complications of phalloplasty in transsexual subjects depending on number of operations performed between 1991 and 2000 |
|||||||||||||||||||||||||||||||||||||||||
|
Как уже отмечалось, осложнения, развившиеся вследствие неправильной выкройки лоскута, в отдаленном периоде могут привести к Рубцовым деформациям неофаллоса. Это, в свою очередь, приводит к различным искривлениям последнего, что является немаловажным фактором для качественной, полноценной жизни пациентов. Такие осложнения отмечены в 5 наблюдениях. Рубцовые деформации неофаллоса устраняли корригирующими операциями. Гематома в области сосудистой ножки лоскута на 1 — 3 сутки после операции отмечена у 4 пациентов. Своевременная эвакуация гематомы привела к гладкому послеоперационному периоду с последующим благополучным исходом. Нагноение раны было отмечено у 2 пациентов, что потребовало проведения санации гнойных очагов и наложения вторичных швов; исход - благоприятный. Расхождение кожных швов на неофаллосе отмечено у 2 пациентов. Причина — раннее снятие кожных швов. В обоих наблюдениях рана заживала вторичным натяжением; исход — благоприятный. Реиннервация мышечной основы лоскута наступила в 80% наблюдений. В случае, когда реиннервация не происходила, или жесткость неофаллоса в отдаленном периоде, по мнению пациента, была недостаточна для интроекции, выполняли эндопротезирование неофаллоса [13]. В табл. 2 показана динамика осложнений фаллопластики у транссексуалов с использованием торакодорсального лоскута в период 1991 — 2000 гг. Увеличение процента осложнений в 1997–98 гг. связано с небольшим количеством выполненных фаллопластик. Из рис. 3 видно, что по мере накопления опыта количество осложнений убывает. |
Four patients developed hematoma on the vascular pedicle of the flap within 1 –3 days after surgery. Its expedient evacuation ensured the uneventful postoperative course and good final result of the treatment. Wound suppuration occurred in 2 patients and was eliminated by the sanation of pyogenic foci and placement of secondary sutures with a good final result. Two other patients suffered a wound rupture on the neophallus provoked by the early removal of the apposition sutures. Both enjoyed wound healing by second intention with a good outcome. Reinnervation of the muscular portion of the flap was documented in 80% of the patients. Whenever it failed to develop, the phalloendoprosthetic treatment was undertaken. The same procedure was employed when the patient was dissatisfied with what he considered as a lack rigidity of the neophallus preventing introjection in the late postoperative period [13]. Table 2 illustrates dynamics of postoperative complications of phalloplasty with a thoracodorsal flap in transsexual subjects between 1991 and 2000. An increased percentage of complications in 1997–1998 was due to a small number of phalloplasties. Fig.3 illustrates decreasing frequency of postoperative complications as the surgeons came to acquire experience in the field. |
||||||||||||||||||||||||||||||||||||||||
ЛИТЕРАТУРА |
REFERENCE |
||||||||||||||||||||||||||||||||||||||||
2.Адамян Р.Т. О полном пластическом восстановлении мужского полового члена, способного к совокуплению // Советская хирургия. Пластическая и реконструктивная микрохирургия в лечении транссексуализма./ / трансДисс. д-ра мед. наук.-М.: 1996.
|
некоторых технических особенностях выполнения фаллопластики из торакодорсального лоскута у транссексуалов // Первый международный симпозиум по лечению транссексуализма. |
||||||||||||||||||||||||||||||||||||||||
Журнал «Анналы пластической, реконструктивной и эстетической хирургии», №1, 2001г.
Magazine «Annals of plastic, reconstructive and aesthetic surgery», №1, 2001.